Pada 5 Julai, Novo Nordisk melancarkan percubaan klinikal fasa III suntikan CagriSema di China, yang tujuannya adalah untuk membandingkan keselamatan dan keberkesanan suntikan CagriSema dengan semeglutide dalam pesakit obes dan berat badan berlebihan di China.
Suntikan CagriSema ialah terapi gabungan bertindak panjang yang sedang dibangunkan oleh Novo Nordisk, komponen utamanya ialah smeglutide agonis reseptor GLP-1 (glukagon-like peptide-1) dan cagrilintide analog amylin bertindak panjang.Suntikan CagriSema boleh diberikan secara subkutan seminggu sekali.
Objektif utama adalah untuk membandingkan CagriSema (2.4 mg/2.4 mg) dengan semeglutide atau plasebo sekali seminggu secara subkutan.Novo Nordisk telah mengumumkan keputusan percubaan CagriSema untuk rawatan diabetes peringkat 2, yang membuktikan bahawa kesan hipoglisemik CagriSema adalah lebih baik daripada semeglutide, dan hampir 90% subjek telah mencapai matlamat HbA1c.
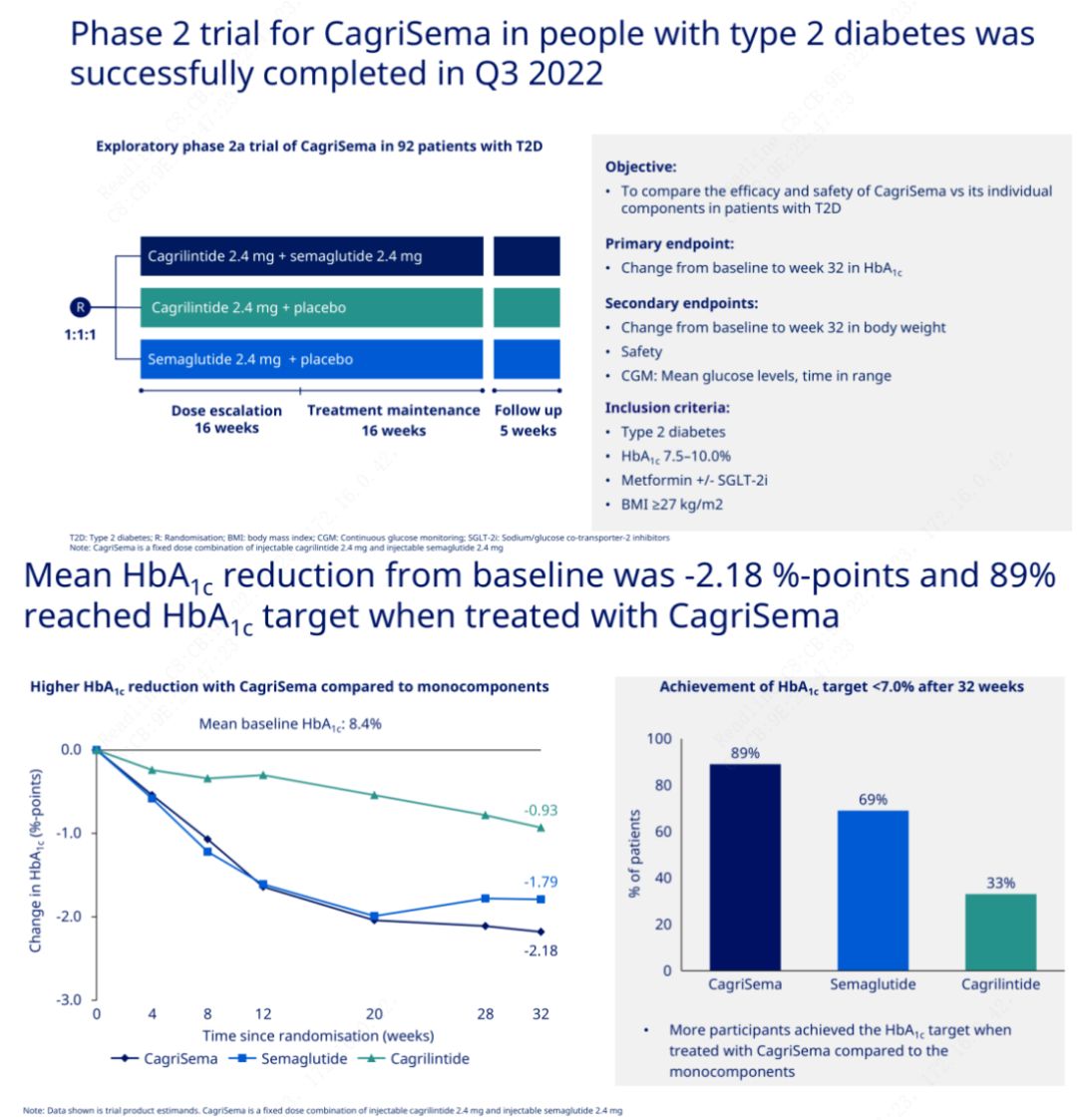
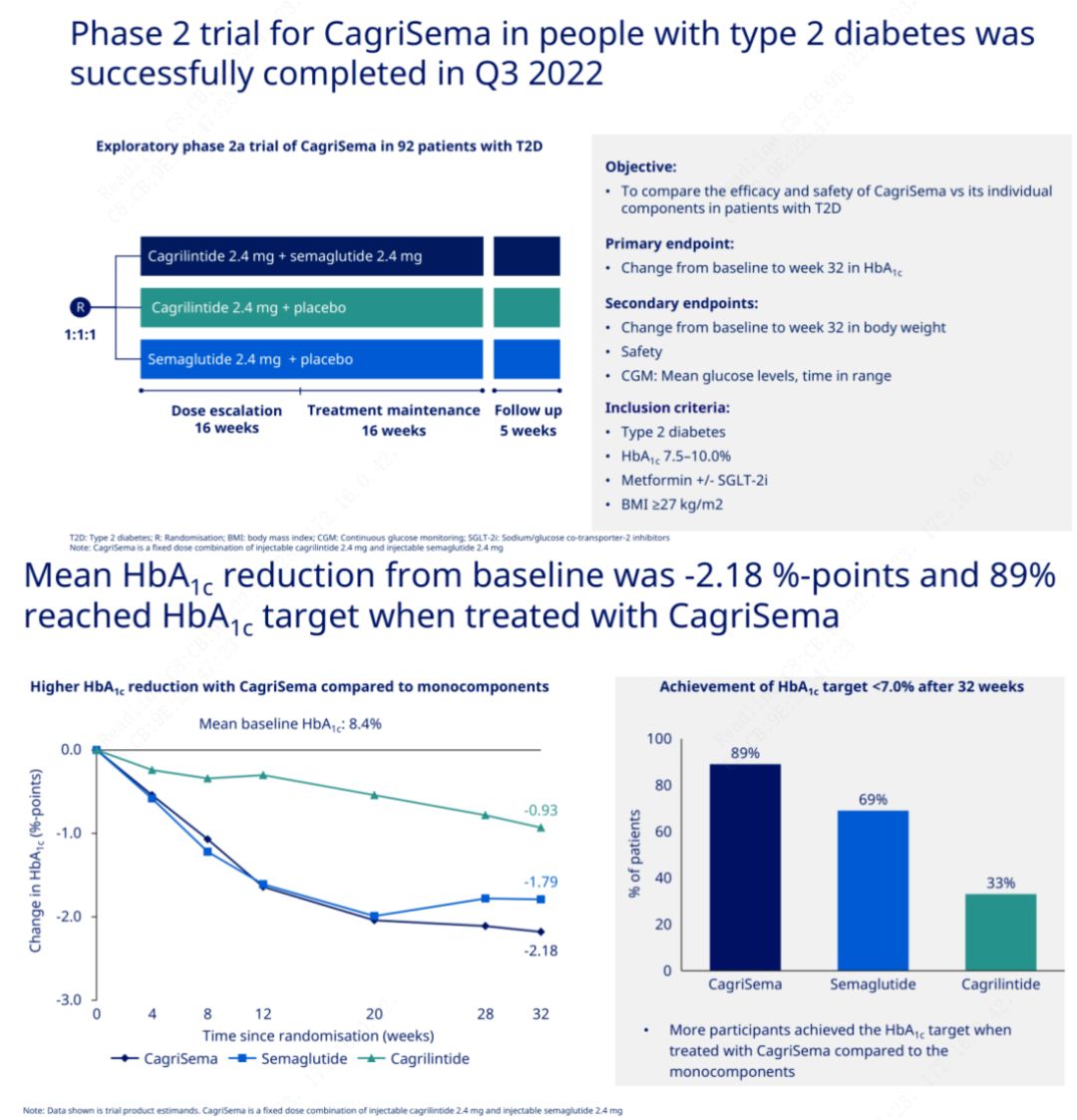
Data menunjukkan bahawa sebagai tambahan kepada kesan hipoglisemik yang ketara, dari segi penurunan berat badan, suntikan CagriSema dengan ketara mengatasi prestasi semeglutide (5.1%) dan cagrilintide (8.1%) dengan penurunan berat badan sebanyak 15.6%.
Ubat inovatif Tirzepatide ialah agonis reseptor GIP/GLP-1 mingguan pertama yang diluluskan di dunia.Ia menggabungkan kesan dua incretin ke dalam satu molekul yang disuntik seminggu sekali dan merupakan kelas rawatan baharu untuk diabetes jenis 2.Tirzepatide telah diluluskan oleh Pentadbiran Makanan dan Ubat (FDA) AS pada Mei 2022 untuk meningkatkan kawalan glisemik (berdasarkan diet dan senaman) pada orang dewasa dengan diabetes jenis 2 dan kini diluluskan di Kesatuan Eropah, Jepun dan negara lain.
Pada 5 Julai, Eli Lilly mengumumkan kajian SURPASS-CN-MONO fasa III mengenai pendaftaran percubaan klinikal ubat dan platform pendedahan maklumat untuk rawatan pesakit diabetes jenis 2.SURPASS-CN-MONO ialah kajian rawak, dua buta, terkawal plasebo fasa III yang direka untuk menilai keberkesanan dan keselamatan monoterapi tirzepatide berbanding plasebo pada penghidap diabetes jenis 2.Kajian itu merancang untuk memasukkan 200 pesakit diabetes jenis 2 yang tidak menggunakan sebarang ubat antidiabetik dalam tempoh 90 hari sebelum Lawatan 1 (kecuali dalam situasi klinikal tertentu, seperti penyakit akut, kemasukan ke hospital, atau pembedahan elektif, jangka pendek (≤14). hari) penggunaan insulin).
Diabetes jenis 2 dijangka diluluskan tahun ini
Bulan lalu, hasil kajian SURPASS-AP-Combo telah diterbitkan pada 25 Mei dalam jurnal blockbuster Nature Medicine.Keputusan menunjukkan bahawa berbanding dengan glargine insulin, Tirzepatide menunjukkan HbA1c dan pengurangan berat badan yang lebih baik dalam populasi pesakit diabetes jenis 2 di rantau Asia-Pasifik (terutamanya China): Pengurangan HbA1c sehingga 2.49% dan pengurangan berat badan sehingga 7.2 kg (9.4%) pada 40 minggu rawatan, peningkatan ketara dalam lipid darah dan tekanan darah, dan keselamatan dan toleransi keseluruhan adalah baik.
Percubaan klinikal Fasa 3 SURPASS-AP-Combo ialah kajian pertama Tirzepatide yang dijalankan terutamanya pada pesakit Cina dengan diabetes jenis 2, diketuai oleh Profesor Ji Linong dari Hospital Rakyat Universiti Peking.SURPASS-AP-Combo adalah konsisten dengan keputusan siri penyelidikan SURPASS global, yang seterusnya membuktikan bahawa patofisiologi diabetes dalam pesakit Cina adalah konsisten dengan pesakit global, yang merupakan asas untuk penyelidikan dan pembangunan serentak ubat-ubatan baru. di China dan dunia, dan juga menyediakan sokongan bukti kukuh untuk memberi peluang kepada pesakit China menggunakan ubat rawatan diabetes terkini dan aplikasi klinikalnya di China secepat mungkin.
Masa siaran: Sep-18-2023

